
转载请注明:解螺旋·临床医生科研成长平台
ImageJ(官网:https://imagej.nih.gov/ij/ )是一个基于java的公共的图像处理软件,它是由National Institutes of Health(NIH)开发的一款功能强大的免费软件,在生物及医学图像分析中起着非常重要的作用。
下图是ImageJ官网的界面,在Download下根据自己系统选择对应的软件下载,ImageJ可以适用于Mac OS X,Linux以及Windows系统(不受电脑系统限制)。生物医学中计数非常常见,下面我们来一起玩转mageJ计数。
1
手动计数

使用Multi-Point工具进行计数
打开ImageJ软件,File,Open打开待分析图片:
点击point工具,右击,选择Multi-Point工具,手动点击进行计数:

点击Analyze–>Measure,可以看见此时计数数量为23个,保存图片即可。
Cell Counter进行细胞计数
点击Plugins–>Analyze–>Cell Counter,界面如下:


点击Initialize,可以对不同类型的细胞进行计数:

可以看见Type1、Type2、Type3计数结果分别为2、1、2个。本方法可以同时对不同类型的细胞进行计数。点击Cell Counter中的Results就可以看见不同类型细胞的数量。Cell Counter与Multi-Point手动计数方法相比可对不同细胞类型计数。

2
常规自动计数过程
打开ImageJ软件,File –>Open打开需要分析的图片:


Image –> Type -> 8-bit (改为灰度图像)

Image -> Adjust -> Threshold 调节阈值,红色代表选中,使所有细胞核均被选中,Dapi图中阈值为11-255 –> Apply

注:荧光图片背景为黑色,需要勾选下面的Dark background,表示背景为黑色
Apply以后图片为:

对于豆子图片,阈值范围为37-255->Apply

Apply后得到图片为:

从上面Apply后的图片可以看到很多细胞连在一起,细胞计数时需要将其分开。

Process -> Binary -> watershed (分水岭分割方法,将连在一起的细胞分开)
得到分割效果如下:

Analyze -> Analyze particles 界面如下:

Size(pixel^2):默认为0-Infinity(无穷大),意思是需要计算的细胞数的细胞大小在哪个区间,比如在此Dapi的细胞大小选择为 500-Infinity,将不是计数目标的杂志点过滤掉,在此我们需要根据目的细胞的大小来试几个最小值就能得到准确的细胞计数结果。
Circularity:表示圆形度,越接近1越接近圆形,我们不需要更改。
Show:我习惯性的选择outlines显示计数的细胞轮廓和计得细胞数编号,还有其他选择。Nothing,图象和叠加图都不会显示;Bare outlines只显示细胞轮廓,不显示编号。
Ellipses:使结果轮廓均匹配为最佳椭圆形。
Masks:填充粒子为8-bit黑白图像。
Count Masks:填充粒子轮廓为16-bit图。
Overlay Outlines:重叠图像里显示测量粒子轮廓。
Overlay Masks:在重叠图像里显示测量粒子轮廓,对于细胞计数来说一般Outlines即可。
下面勾选的是Display results,显示结果。
Clear Results:重复测量之前被测量的结果将被清除;
Summarize:对结果做总结;
Exculde on edges:排除边缘接触的细胞,不进行计数;
Include holes:内部孔洞会被包括在内;
Add to Manager:测量粒子添加到ROI管理器;
Record Starts:允许插件和宏函数重新创建粒子轮廓;
In Situ Show:原位显示,原始图像会被下拉菜单中指定的二值图像(非黑即白)替代。
得到结果如下:


豆子得到结果如下:


应用实例:

打开图片:

转换RGB图像为灰度图片:Image –>Type –>8-bit。

阈值选定:Image–>Adjust–>Threshold–>阈值选定–>红色代表选中。皿边缘高亮部分影响菌落的选中,使用椭圆选框大致选中菌落所在区域。
Analyze–>Analyze particles,选择如下,点击OK,得到计数结果:

3
ImageJ多孔材料的自动计数
打开ImageJ软件,File–>Open打开需要分析的图片:

Process–>FFT–>Bandpass Filter–>OK:


Process–>Find Maxiam–>Output type 选择Count可得到计数数据:


4
RetFM-J自动计数
打开ImageJ软件,File–>Open打开需要分析的图片:

Plugins–>CLAHE增强对比度–>点击OK


Plugins–>RetFM-J–>OK


细胞总数为834个,以及Area,坐标(X,Y),Perim等其他指标。

5
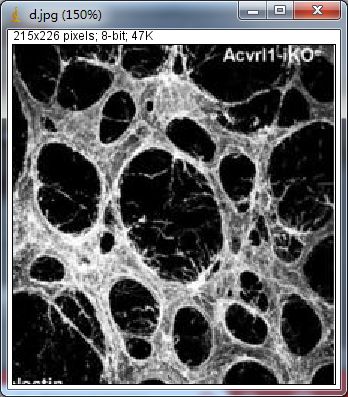
细胞核着色DAB显色组化计数
打开ImageJ软件,File–>Open打开需要分析的图片:

点击Plugins–>IHC tools
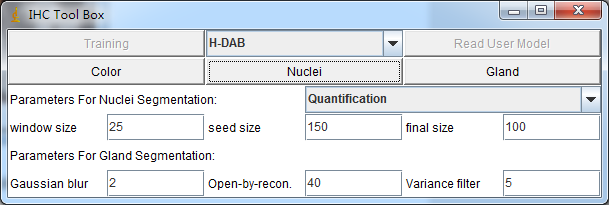
选择H-DAB–>Nuclei,得到结果为34个。


6
快速树突棘密度分析方法及细胞计数
从高尔基染色图片中截取待分析树突:

打开Fiji,File–>Open待分析的树突棘图片(以DG为例)

将图片由RGB图像改为灰度图片:Image–>Type–>8-bit;

转换图片为二值化图片:Image–>Adjust–>Threshold(调节阈值至树突及树突棘完全选中),点击Apply二值化完成。二值化图片如下(非黑即白,灰度值为0或255):
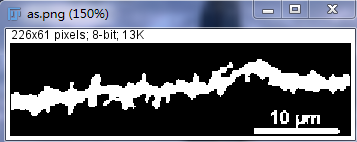
校正标尺:点击Straight工具

、按住Shift在标尺上画直线

Analyze–>Set Scale–>在已知距离中填入10 μm–>选择Global则校正标尺对本次打开所有图片均有效。此时也有Step1中226 x 61 pixels变为下图的40.36 x 10,89 μm。

骨骼化已经二值化的图像:Process–>Binary–>Skeletonize,得到骨骼化图像;

清除标尺,避免其干扰树突棘计数:File菜单下矩形选框选中标尺位置,如下图。

Edit–>Clear(清除选框内的内容):

由骨骼图像分析树突棘数量:Analyze–>Skeleton–>选择如下–>点击OK。

得到结果:

End-point voxels共有25个,既有25个树突棘(上图中蓝色点)。
结果往右拉可以看见最长的路径为45.31 μm(树突的长度),即本图像的树突棘的密度(Spine density)为25/45.31=0.55 /μm,一般统计时纵坐标为Spine density (Spines /10 μm),本图像为5.5 /10 μm。
7
对不同形状自动计数
打开ImageJ软件,File–>Open打开需要分析的图片,示例图片含有两种不同形状,3个三角形,4个圆形:

Image –> Type -> 8-bit (改为灰度图像)
Image -> Adjust -> Threshold 调节阈值,红色代表选中,使所有图形均被选中:

Analyze -> Analyze particles 界面如下:

如前所述Circularity表示圆形度,越接近1越接近圆形,我们可以根据形状圆度的差别对两种形状进行计数。
对于圆形形状,Circularity设置0.:8-1,Show 选择Outline,得到结果只特异性计数了4个圆形形状:

对于三角形形状,Circularity设置0-0.5,Show 选择Outline,得到结果只特异性计数了3个三角形形状:

ImageJ计数今天分享到这里,希望对大家有所帮助,祝大家早日发文章,左手CNS右手,右手国自然!返回搜狐,查看更多
责任编辑: