2018 年 6 月 1 日,在中国医师协会神经内科医师分会年会石家庄会场的神经感染论坛上,北京协和医院神经科主任医师关鸿志教授做了《自身免疫性脑炎的诊疗进展——以中国共识为新起点》的报告,对自身免疫性脑炎的诊疗进展,从临床分类、诊断标准以及治疗方法等方面进行了细致的分享。
脑炎及自身免疫性脑炎相关概念
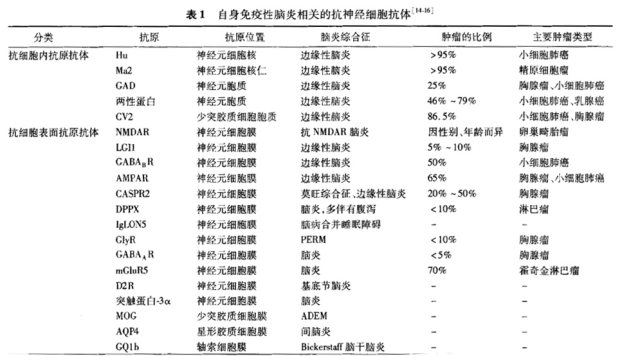
脑炎是由脑实质的弥漫性或者多发性的炎性病变导致的神经功能障碍。自身免疫性脑炎(AE)泛指一类由自身免疫机制介导的脑炎。经典的副肿瘤边缘性脑炎,其靶抗原位于神经元细胞内;而以抗 NMDAR 脑炎为代表的新型 AE,其致病抗体主要针对神经元细胞表面蛋白与受体。《中国自身免疫性脑炎诊治专家共识》(简称《共识》主要是对抗神经细胞表面蛋白抗体相关的 AE 予以讨论。《共识》对 AE 相关的抗神经抗体进行了介绍与列举(表 1)。
自身免疫性脑炎的临床类型及特点
1. 抗 NMDA 受体脑炎:属于 AE 的一种独立类型,也是最常见一种 AE, 临床符合弥漫性脑炎,不同于经典边缘性脑炎。
2. 边缘性脑炎:包括抗 LGI1、GABA-bR、AMPAR 脑炎: 以精神行为异常、颞叶癫痫发作和近记忆力障碍为主要症状,脑电图和影像学符合边缘系统受累。
3. 其他综合征包括中枢以及周围神经受累的类型,患者临床表现各不相同。
Morvan 综合征主要是抗 CASPR2 抗体介导的,抗 DPPX 抗体相关脑炎主要是由 DPPX 抗体介导,都具有中枢和周围神经系统受累的表现。
抗 IgLON5 脑病是由抗 IgLON5 抗体介导的 tau 蛋白病,此病是首个被发现的由抗神经抗体介导的神经变性病,表现为慢性进行性脑病,严重的睡眠障碍,帕金森病或者多系统萎缩样的临床表现,国际上累计报告数十例,国内报道 4 例,部分病例免疫治疗有效。
基底节脑炎主要是由多巴胺受体(D2)抗体介导。典型的自身免疫性边缘性脑炎如图 1 所示(抗 LGI1 脑炎的头 MRI 与 PET),头核磁共振 FLAIR 像对 AE 比较敏感。
抗 GABA-B 受体脑炎(图 2):国际上最早于 2010 年报道。患者主要的临床表现为癫痫、记忆力减退、精神行为异常,其特点为难治性癫痫或者癫痫持续状态。33%~47% 的患者合并肿瘤,一般以小细胞肺癌为主。头磁共振一般在颞叶内侧出现病灶。90% 的患者出现脑脊液的异常改变,80% 的患者脑脊液淋巴细胞增高。该脑炎也可以合并其他抗体的阳性,如合并抗 Hu 抗体阳性,指向小细胞肺癌。治疗包括免疫治疗与抗肿瘤治疗。脑炎症状在免疫治疗后可缓解。
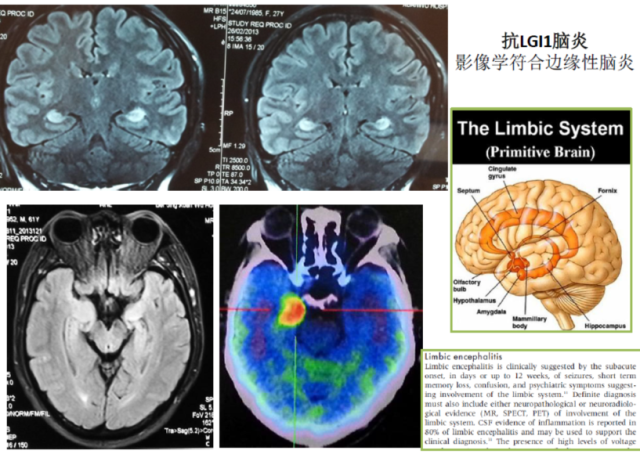
图 1 自身免疫性边缘性脑炎神经影像学
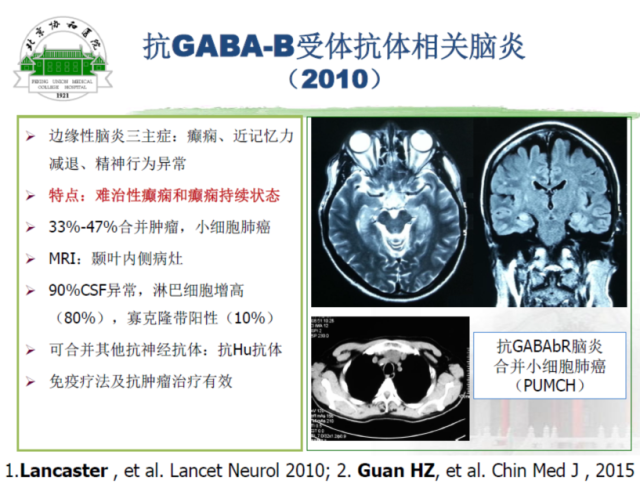
图 2 抗 GABA-B 受体脑炎合并小细胞肺癌(PUMCH)
自身免疫性脑炎的评估程序
很多自身免疫性疾病可以合并自身免疫性脑炎同时出现,如亚甲炎合并自身免疫性脑炎,白癜风合并自身免疫性脑炎等。《共识》对自身免疫性脑炎诊断评估程序进行了推荐(表 2)。

自身免疫性脑炎的诊断
1.自身免疫性脑炎诊断的中国标准:以抗体阳性为必要条件,适用于各型 AE
《共识》将 AE 的诊断标准分为可能的 AE 和确诊的 AE。诊断标准包括临床表现、辅助检查、确诊实验与排除其他病因 4 个方面。
(1)临床表现:急性或者亚急性起病(<3 个月),具备以下 1 个或者多个神经与精神症状或者临床综合征。
边缘系统症状:近事记忆减退、癫痫发作、精神行为异常,3 个症状中的 1 个或者多个。
脑炎综合征:弥漫性或者多灶性脑损害的临床表现。
基底节和(或)间脑/下丘脑受累的临床表现。
精神障碍,且精神心理专科认为不符合非器质疾病。
(2)辅助检查:具有以下 1 个或者多个的辅助检查发现,或者合并相关肿瘤。
脑脊液异常:脑脊液白细胞增多(>5×106/L);或者脑脊液细胞学呈淋巴细胞性炎症;或者脑脊液寡克隆区带阳性。
神经影像学或者电生理异常:磁共振成像(MRI)边缘系统 T2 或者液体衰减反转恢复(FLAIR)异常信号,单侧或者双侧,或者其他区域的 T2 或者 FLAIR 异常信号(除外非特异性白质改变和卒中);或者 PET 边缘系统高代谢改变,或者多发的皮质和(或)基底节的高代谢;或者脑电图异常:局灶性癫痫或者癫痫样放电(位于颞叶或者颞叶以外),或者弥漫或者多灶分布的慢波节律。
与 AE 相关的特定类型的肿瘤,例如边缘性脑炎合并小细胞肺癌,抗 NMDAR 脑炎合并畸胎瘤。
(3)确诊实验:抗神经抗体阳性(抗体见表 1)。
建议对患者的配对的脑脊液与血清标本进行检测,脑脊液与血清的起始稀释滴度分别为 1:1 与 1:10。主要采用间接免疫荧光法,根据抗原底物分为基于细胞底物的实验(CBA)与基于组织底物的实验(TBA)两种。
(4)合理地排除其他病因(鉴别诊断参考《共识》)。
符合上述诊断条件中的第 1、第 2 与第 4 条,诊断为可能的 AE;符合上述诊断条件中的第 1~4 条,诊断为确诊的 AE。
2. 国际自身免疫性脑炎的诊断建议——「抗体阴性」的悖论与陷阱
2016 年 2 月 Graus 与 Dalmau 等在 Lancet Neurol(《柳叶刀·神经病学》)发表的《自身免疫性脑炎的诊断建议》中提出:确诊自身免疫性边缘性脑炎可以不依赖抗体诊断——即所谓「抗体阴性的自身免疫性边缘性脑炎诊断标准」,但当时并没有发表具体的研究结果支持该建议。
Graus 等于今年发表的研究显示:抗体阴性的自身免疫性边缘性脑炎的比例仅有 7%,因此抗体阴性的 AE 相对少见,诊断需要慎重,需进行充分的鉴别诊断,特别是与感染性脑炎鉴别。为避免诊断过度,中国《共识》未采用该「抗体阴性」标准,抗体阳性仍是确诊的必要条件。以下病例或可说明 AE 过度诊断的倾向:
一位老年男性患者,因言语不清,反应迟钝 1 月余收入我院。病初外院脑脊液细胞学为淋巴细胞性炎症,抗神经抗体阴性,MRI 仅提示一些慢性脑小血管病的表现,外院怀疑为「抗体阴性的自身免疫性脑炎」,给予激素冲击与丙球治疗后症状明显加重;发病一个月后来我院,复查 MRI 提示左侧顶、颞、枕叶广泛灰质病变,行脑脊液二代测序发现单纯疱疹病毒Ⅰ型,阿昔洛韦治疗后明显好转(图 3)。
就脑炎总体的病因构成而言,感染性脑炎的病例数应超过自身免疫性脑炎,单纯疱疹病毒Ⅰ型是成人最常见的病毒性脑炎,脑脊液 PCR 与脑脊液二代测序等病毒核酸检测是诊断病毒性脑炎的主要方法,流行季节进行抗乙型脑炎病毒抗体检测也非常必要。
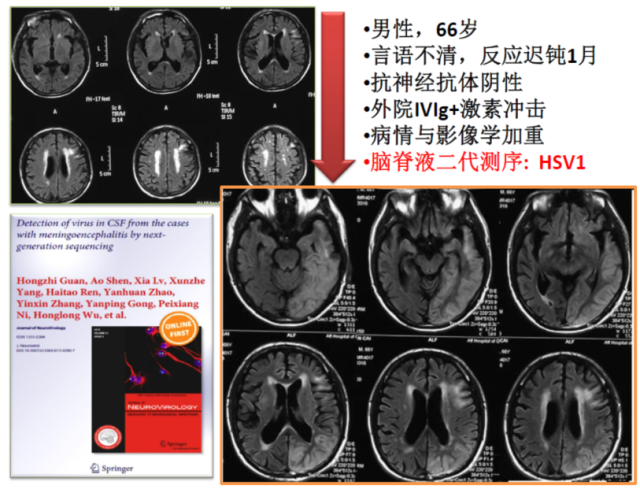
图 3 脑脊液二代测序对病毒性脑炎的鉴别诊断具有重要价值
3. 抗 NMDAR 脑炎确诊标准,需要同时满足以下 3 个条件:
6 项主要症状中的一项或者多项:① 精神行为异常或者认知障碍;② 言语障碍;③ 癫痫发作;④ 运动障碍/不自主运动;⑤ 意识水平下降;⑥ 自主神经功能障碍或者低通气。
抗 NMDAR 抗体阳性:以脑脊液 CBA 法抗体阳性为准——CSF Only 原则。若仅有血清标本检测阳性,则不具有确诊意义。
合理排除其他病因。
需要指出,在抗 NMDAR 脑炎诊断条件中,没有将脑电图、神经影像与一般性脑脊液检查列入其中:一方面这些辅助检查缺少足够的特异性,另一方面也是由于脑脊液抗 NMDAR 抗体具有极高的特异性——现有的对照性研究结果显示脑脊液抗 NMDAR 抗体特异性为 100%。
自身免疫性脑炎的治疗
1. 免疫治疗
一线免疫治疗:糖皮质激素,静脉免疫球蛋白(IVIg)和血浆置换。对于可能的 AE(抗体阴性),可酌情试用一线免疫治疗药物。二线免疫治疗:利妥昔单抗与静脉环磷酰胺,主要用于一线免疫治疗效果不佳的患者。长程免疫治疗:吗替麦考酚酯与硫唑嘌呤等,主要用于复发病例,也可用于一线免疫治疗及效果不佳的患者和肿瘤阴性的抗 NMDAR 脑炎患者。
2. 糖皮质激素治疗的方案
一般采用冲击治疗:甲泼尼龙 1000 mg/d,连续静脉滴注 3 天,然后改为 500 mg/d,3 天。而后可减量为甲泼尼龙 40-80 mg/d, 2 周;或者改为口服醋酸泼尼松 1 mg/kg/d,2 周(或者口服甲泼尼龙,按 5 mg 醋酸泼尼松=4 mg 甲泼尼龙);之后每 2 周减 5 mg。对于轻症患者,可以不采用冲击治疗而采用口服激素,口服激素总疗程 6 月左右,在减停激素的过程中需要评估脑炎的活动性,注意病情的复发与波动。
3. 免疫球蛋白治疗方案
按总量 2 g/kg, 分 3~5 天静脉滴注,对于重症患者,建议与激素联合使用。重症患者可以重复 IVIg,可每 2 周~4 周重复应用 IVIg;以多轮 IVIg 为基础的强化一线免疫治疗方案适用于重症 AE 患者,可以作为以利妥昔单抗为主的二线治疗的替代方案,在《共识》的治疗路线中予以体现(图 4),可供参考。在中国已发表的成年人 AE 队列中,利妥昔单抗使用比例普遍偏低(10%~20% 以下),但预后不逊色于国外的高比例利妥昔单抗队列。
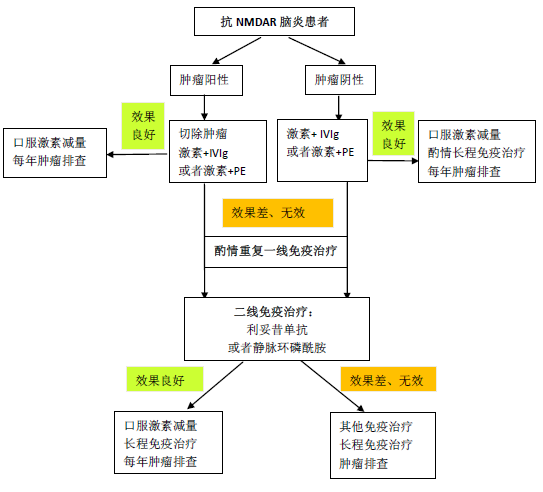
图 4 抗 NMDAR 脑炎的治疗流程可供其他类型 AE 参考
4. 吗替麦考酚酯方案:是 AE 长程免疫治疗首选药物,安全性良好。对于重症与难治性 AE,宜尽早加用足量的吗替麦考酚酯,以期尽快起效。该药对 B 细胞与体液免疫具有相对选择性的抑制作用,因此对于以体液免疫反应为主的神经免疫病具有良好的应用前景。中国《共识》推荐吗替麦考酚酯为 1 g-2 g/d;北京协和医院的吗替麦考酚酯治疗 AE 研究结果刚刚发表在《中华神经科杂志》上:我们目前的诱导期剂量为 1.5-2 g/d,个别病例可达 3.0 g/d,病情缓解后可改为 0.75-1.5 g/d 的维持期剂量;总疗程不短于 1 年;我们建议将周围血 B 淋巴细胞绝对值与 IgG 水平等作为剂量个体化的依据。
自身免疫性脑炎诊疗面临的问题
自身免疫性脑炎诊疗目前还存在诸多问题与难点需要解决,探索答案。首先,对新的、未知的抗神经抗体的探索仍在进行当中,一些抗体的临床意义有待评估。其次,对重症、难治性、复发性 AE 的治疗方案有待探索与评估。在探索新的免疫治疗方法方面,应从 AE 的病理与免疫机制上寻找突破点,例如抗 NMDAR 脑炎具有抗体鞘内合成特点,B 细胞与浆细胞主要分布于脑内小血管周围与软脑膜下;对于一线治疗与二线治疗药物均没有效果的患者,可以试用鞘内注射氨甲氨喋呤等药物治疗,我们报道了北京协和医院的鞘内免疫治疗经验,但尚需要大样本的临床研究评估其疗效与安全性。

关鸿志,医学博士,北京协和医院神经科主任医师,教授,脑脊液细胞学、脑炎与副肿瘤综合征项目负责人。中华医学会神经病学分会感染与脑脊液细胞学学组委员,中国医师学会神经感染分会委员,北京神经内科学会神经感染与免疫学组副主任委员,北京脑炎协作组组长,中国研究型医院学会神经病学分会脑炎协作组组长。
文中用图由作者提供
封面图来源于|CORPORATE